在刚刚过去的2018CSCO(中国临床肿瘤学会)大会上,太阳集团tyc官方入口成功召开了主题为“新生抗原,让肿瘤免疫更有效!暨太阳集团tyc官方入口bTMB产品发布会”的卫星会。本次卫星会干货满满,继上期高志博博士为大家分享“让肿瘤免疫更有效,新生抗原有话说”之后,今天小编将再次为大家带来精彩的报告回顾,本期登场的是来自南京军区总医院呼吸内科主任宋勇教授为大家带来的精彩内容:

肺癌个体化治疗的发展
在肺癌的个体化治疗发展中,经历了化疗到靶向治疗再到现在炙手可热的免疫治疗,使得越来越多的肺癌患者能够从中获益。
免疫治疗包括主动免疫和被动免疫,我们现在用到的免疫检查点抑制剂就属于主动免疫当中的非特异性抗体依赖的免疫调节疗法,它能解除肿瘤对免疫系统的抑制,提高免疫系统识别杀伤肿瘤的能力,从而实现临床上治疗肿瘤的目的。
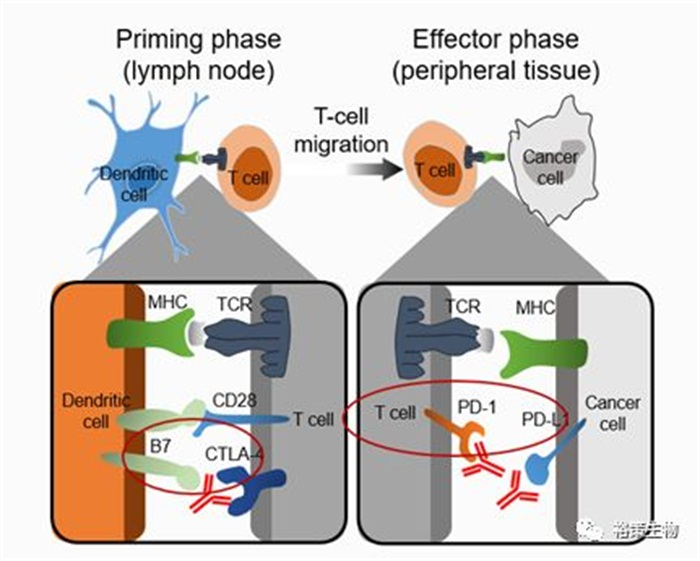
图1.用于癌症治疗的免疫检查点抑制剂
抗CTLA-4抗体解除抑制是在免疫系统启动阶段,抗PD-1/PD-L1抗体解除的抑制是在效应阶段,CM227中也看到了双免药物联合的临床试验结果还是比较好的,当然毒副作用也有待评价。
基于免疫检查点抑制剂的临床试验结果,FDA批准了11个适应症,其中包括了一个分子指征,使得部分肿瘤患者可以从中获益,在今年的6月及7月NMPA也将O药和K药纳入了肺癌的二线治疗,使得国内的患者也可以接受两款抗PD-1抗体药物的治疗。
然而,我们也遗憾的看到免疫检查点抑制剂的临床响应率还十分有限,在肺癌中只有19.2%,综合其它实体瘤种也只有20%-30%左右的临床响应率。基于这样的现状,各个临床试验也开展患者入组前,通过相关biomarker来筛选潜在获益人群,来提高药物的有效率。
肺癌免疫治疗Biomarker
目前肺癌免疫治疗通用的三个biomarker为PD-L1表达、MSI、TMB,那么接下来我们就不同的Biomarker进行一下讨论。
1. PD-L1表达 首先是作为药物作用靶点PD-L1表达的探索、证据以及挑战。
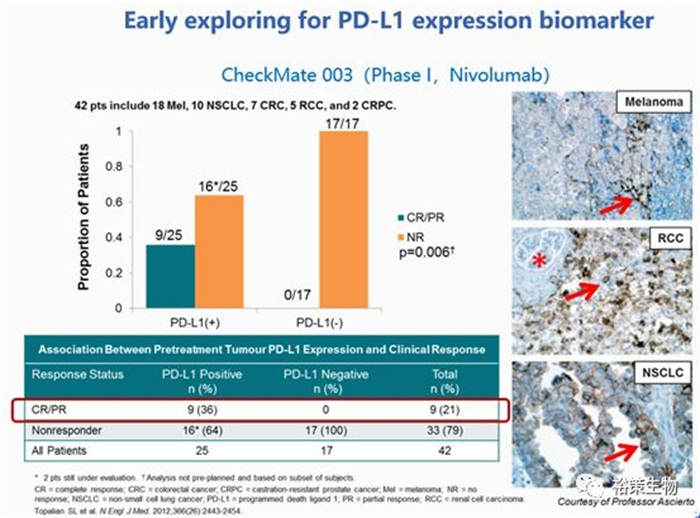
图2. PD-L1表达的早期探索
CM-003对不同瘤种当中的PD-L1表达情况做了分析,结果显示对药物临床反应效果好的患者(CR/PR)均来自于PD-L1表达阳性的患者,另外,也显示部分PD-L1表达阳性的患者对药物没有响应。PD-L1表达量采用的是IHC的方式,平台,试剂的不同也会对结果有所影响,蓝印计划应运而生。
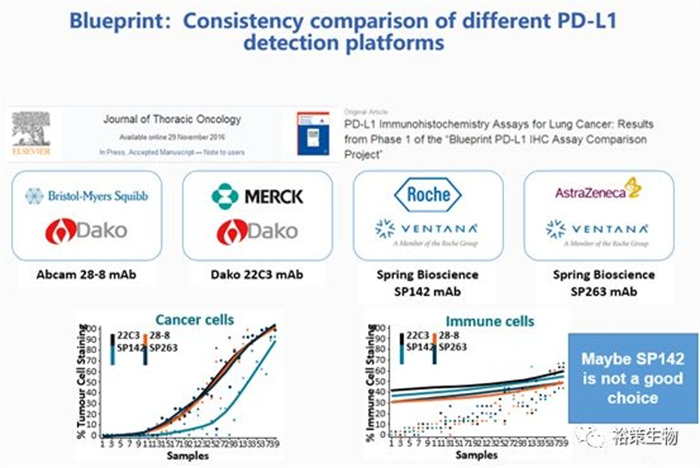
图3.蓝印计划:不同PD-L1表达检测平台的一致性比较
通过不同平台,不同抗体试剂的一致性研究显示SP142可能在PD-L1表达量检测上可能不是一个很好的选择,同时已发表的PD-L1 不同免疫组化检测一致性研究显示,PD-L1评估最大的问题就是缺乏临床疗效的数据,接下来我们看看在一线和二、三线治疗中PD-L1表达量和ORR的对应情况,无论是KN还是CM的一线临床试验还是二、三线的临床试验都显示了出了PD-L1表达量作为biomarker的ORR在50%左右,还有提升的空间,检测没有统一和规范的前提下,如何确认分析和疗效的一致性:不同检测平台分析的一致性可确认 ——疗效的一致性仍需更多数据验证。
2. TMB
近年来科学家们对Biomarker-TMB(肿瘤突变负荷)进行了探索

图4.TMB的发展史
从2014年的第一篇研究性文献提示了TMB与免疫治疗之间响应有相关性到2018年CheckMate227双免药物联用中TMB高的患者获益,同时高TMB的患者,无论PD-L1表达情况,均可获益,使得TMB这一指标越来越被临床所接受,未来很可能应用到临床用药指导上。
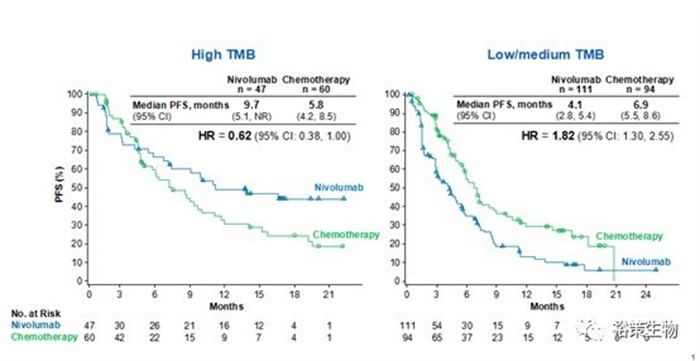
图5. CM 026临床回顾性分析, TMB作为O药治疗NSCLC分组的biomarker
2017AACR大会最新报告中研究人员采用TMB作为标志物对CheckMate 026三期临床试验进行回顾性研究,结果显示,相比PD-L1,选择TMB作为Opdivo治疗NSCLC的biomarker,能更好地区分获益人群。
该研究发现,在TMB高表达的病人中,采用Opdivo进行治疗后,ORR(客观缓解率47% vs. 28%)和PFS(无进展生存期,9.7月 vs. 5.8月)结果显著优于化疗,这一结果为BMS公司的Opdivo药物作为NSCLC一线用药带来新希望。可以预见,未来将有更多药企会考虑将TMB纳入ICIs药物临床试验的检测范围。
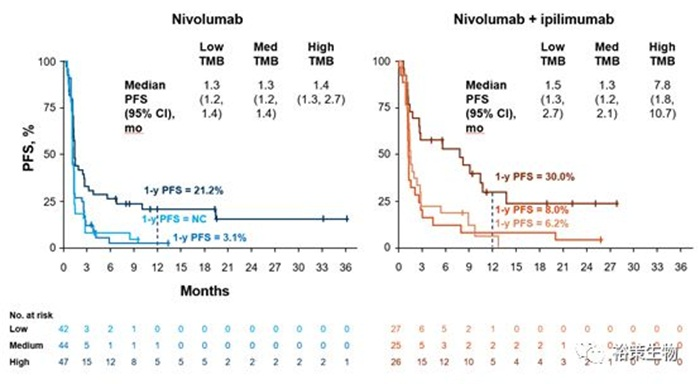
图6.TMB指标在联合用药中作为biomarker的可行性的探索
以上研究包含复发或者晚期SCLC在内多种实体瘤患者,进行双免疫药物治疗的I/II期临床试验,双药联用的获益人群比例随着TMB的升高而增加,也提示了TMB在联合用药中作为biomarker的可行性。
3. TNB (Tumor Neoantigen Burden)
TNB作为潜在预测免疫检查点抑制剂疗效的biomarker,业界也对它进行了探索
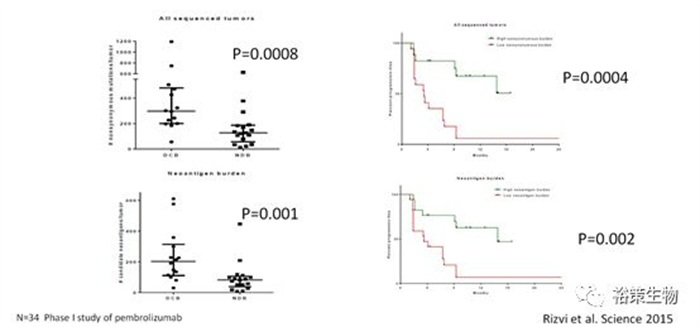
图7.突变和新生抗原预测NSCLC患者使用PD-1抑制剂药物的疗效
2015年science上发表的研究表示高突变负荷和高新生抗原负荷的患者有更好的临床疗效,让我们看到了新生抗原在临床应用上的可能性。
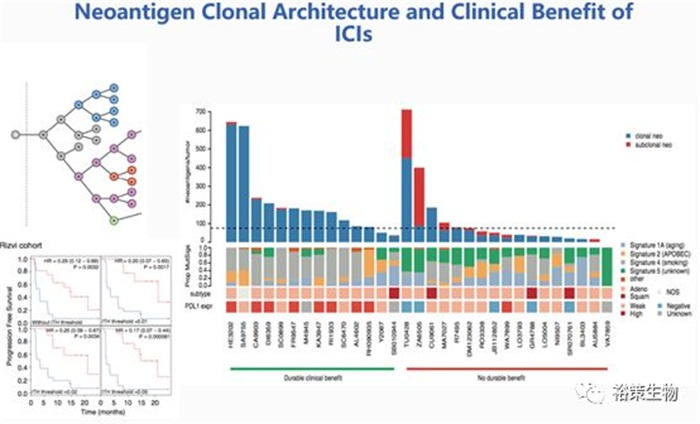
图8. 新生抗原的克隆异质性影响免疫抑制剂的临床疗效
新生抗原的克隆异质性影响免疫治疗疗效,与突变一样,这些突变产生的新抗原显示肿瘤内异质性,即部分存在于所有肿瘤细胞中(主克隆),另外一部分仅存在于小部分肿瘤细胞中(亚克隆)。 图8左下图显示的就是肿瘤新生抗原内部异质性不设阈值、阈值设为1%、2%和5%时,高新生抗原的患者与低新生抗原的患者在PFS方面的显著差异。
2015年science一项关于肺癌和黑色素瘤的研究中,McGranahan等人发现肿瘤克隆性新生抗原的负荷高低与患者存活率相关,肿瘤浸润淋巴细胞多少与免疫疗法的持久反应相关。
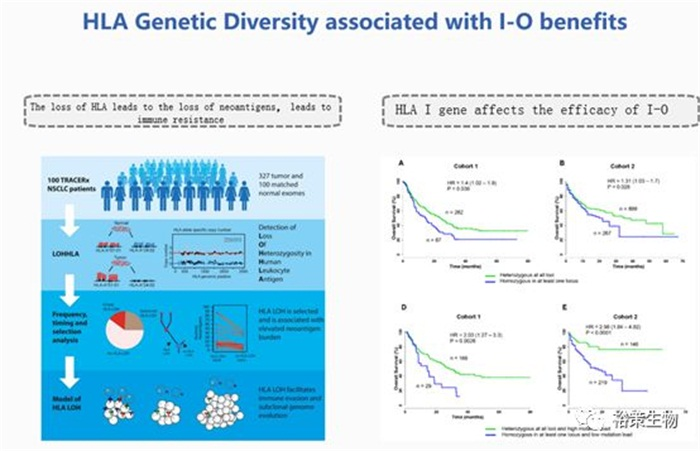
图9.HLA的遗传多样性与免疫治疗的疗效相关
另一个影响新生抗原的因素HLA基因型的多样性:HLA -I位点杂合及HLA等位基因多样的患者对IO治疗疗效好,HLA-I 等位基因多样且高突变负荷的患者对IO治疗疗效好,反之,如果HLA出现杂合性缺失带来的就是耐药的结果。
非小细胞肺癌(NSCLC)患者中,HLA LOH发生率在40%左右。,并且与亚克隆新生抗原负荷高,PD-L1上调相关,是一种免疫逃逸机制。对HLA LOH的分析可以使我们对免疫耐药机制有所了解。
除此之外,科学家们还对其他Biomarker进行了探索。
总之,在使用PD-1/L1等免疫检查点抑制剂之前需要对多个biomarker进行综合评估,以便精细化指导临床用药,以下是宋勇主任给大家分享的肺癌真实世界的案例。
肺癌真实世界的案例
案例1:
患者:XX,男,66 岁
临床诊断:左上肺鳞癌,T4N2M0
治疗:2017.12.19—2018.03.21一线化疗 PD —>2018.04.18开始IBI308治疗
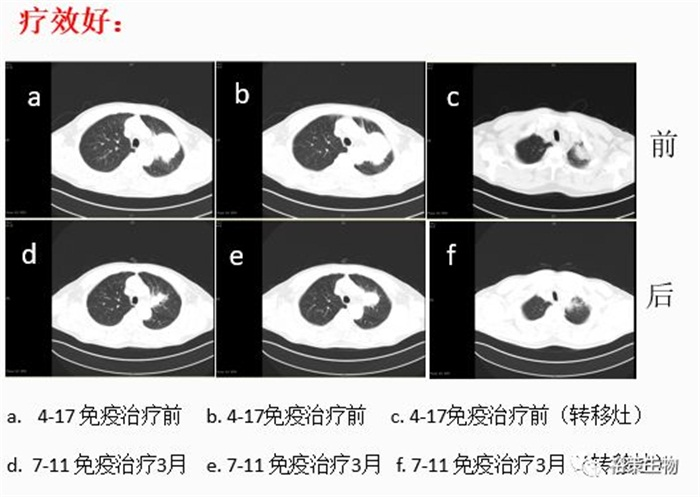

案例分析:该患者用YuceOne®系列免疫诊断产品进行检测后,发现TMB-H,TNB-H,HLA LOH阴性,这些指标提示患者对免疫药物敏感性较高,表示可以用药,且用药效果好。
案例2:
患者:XX,女,69,
临床诊断:左下肺腺癌
治疗:2018 年 5 月 29 日开始用帕博利珠单抗治疗
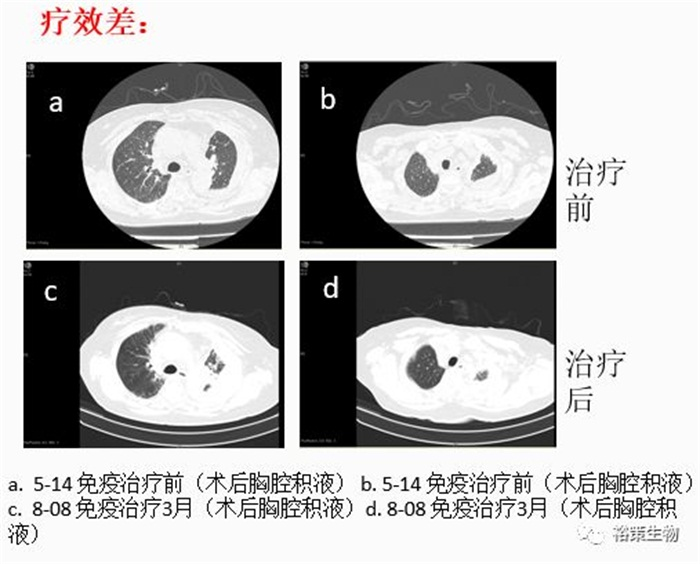

案例分析:该患者用YuceOne®系列免疫诊断产品进行检测后,发现PD-L1低表达,TMB-M,TNB-M,EGFR 19号外显子缺失,这些指标提示患者对免疫药物敏感性低,用药效果不理想。
案例总结:在使用肿瘤免疫药物治疗前,进行免疫检测是非常必要的,它能够有效地指导临床用药,让肿瘤免疫治疗更加精准。
参考文献
1.McLaughlin J et al. JAMA Oncol. 2016;2(1):46-54.
2.Heskamp S et al. Cancer Res. 2015;75(14):2928-2936.
3.Pardoll DM. Nat Rev Cancer. 2012;12:252-264.
4.Wilson BE et al. J Immunol Methods. 1991;139:55-64.
5.Phillips T et al. Appl Immunohistochem Mol Morphol. 2015;23(8):541-549.
6.Rimm D et al. Breast Cancer Res Treat. 2014;147(2):457-458.
7.Velcheti V et al. Lab Invest. 2014;94(1):107-116.
8.Warth A et al. Recent Results Cancer Res. 2015;199:71-84.
9.Detterbeck FC et al. Chest. 2013;143(5 Suppl):e78S-92S.
10.Peters et al, AACR 2017;Carbone et al, NEJM 2017
Copyright©2021
太阳集团tyc官方入口 - 太阳集团游戏官方网址 版权所有
粤ICP备16128839号
