免疫诊断是伴随肿瘤免疫治疗出现的真实临床需求,临床上如何通过biomarker筛选免疫治疗的获益人群是一个热点问题,而TMB则是继PD-L1表达、MSI-H/dMMR之后最有希望成为抗PD-1药物伴随诊断的候选biomarker。而就在刚刚召开的2019WCLC上Keynote 189,Keynote 021相继公布的结果都表明,tTMB(基于组织样本的TMB)不能预测Keytruda和化疗联合治疗NSCLC生存获益的优势人群(见表1)。因此,原本有希望成为O药甚至其它抗PD-1药物伴随诊断的TMB的前途变得扑朔迷离,甚至TMB作为免疫治疗疗效预测biomarker的有效性也遭到了质疑。
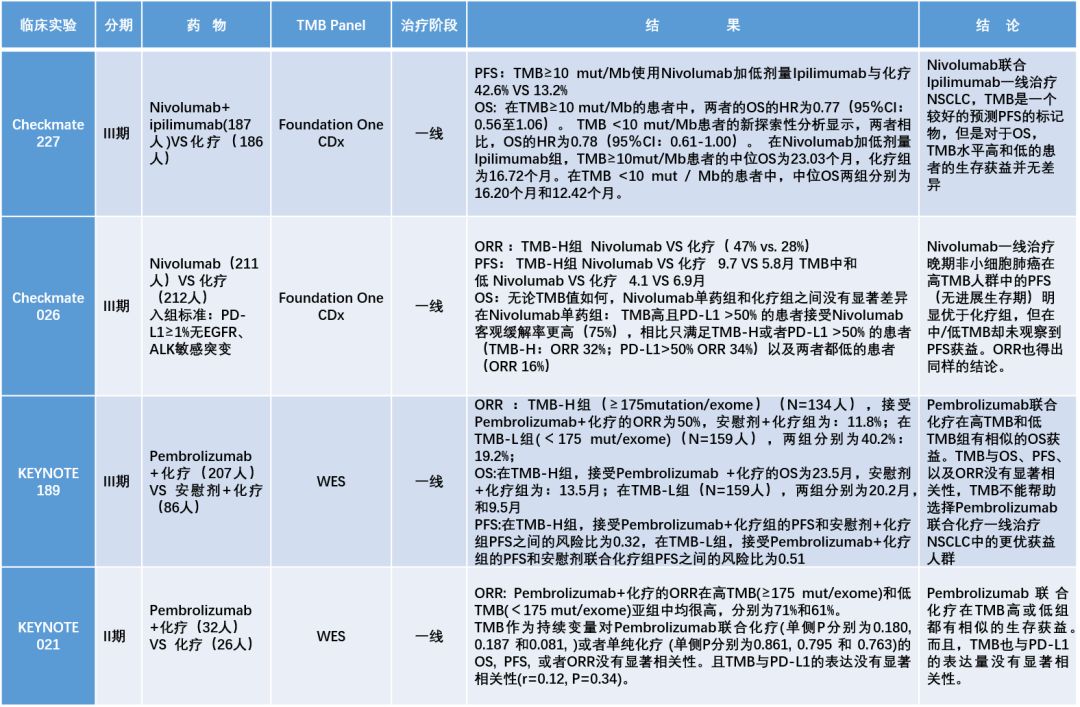
表1 TMB相关临床试验概览
太阳集团tyc官方入口作为在国内最早提供TMB检测的基因检测公司,一直致力于免疫诊断biomarkers的验证和开发,以及免疫治疗多指标综合评估模型的研发。
关于TMB的现状和未来发展趋势,我们结合长期对肿瘤免疫的理解,以及对多位业界专家的调研访谈,分享观点如下:
TMB在免疫单药治疗和联合治疗中的价值要分开
Keynote 189和021都是免疫联合化疗,TMB对于联合治疗尤其是联合化疗的疗效预测价值不高,从这两个临床试验的结果来看几乎可以得到肯定。从原理上解释:化疗可以通过多种机制改善肿瘤微环境和宿主免疫应答,如免疫原性细胞死亡,局部T细胞浸润,删除免疫抑制性细胞如Treg和MDSC,因此疗效并不一定和TMB直接相关;从这个角度,IO+IO,依赖的还是患者免疫系统的识别能力,已经报道的结果已经表明TMB在提示药物反应的有效性,至于是否能够提示生存获益,这要看即将到来的ESMO上 Checkmate 227 part2的结果公布。
目前TMB在免疫单药治疗中的预测价值无可否认。基于肿瘤免疫的基础理论,TMB可以间接反映新生抗原(neoantigen)水平,neoantigen越多,PD-1抗体解除PD-1/L1抑制机制后,肿瘤被免疫细胞识别并杀伤的概率越大,故其机制与PD-1的作用机制相关。不论是Keynote 001还是Checkmate 026,乃至今年年初发表在Nature Genetics上的1,662 例多癌种TMB和ICI疗效分析结论都证明了这点。基于Checkmate 227和026的结果,TMB也因此被写入了NCCN指南。但TMB对于单药治疗的有效性还需要更多的数据。
TMB在单药和联合治疗中的价值要分开看,联合治疗的机理更为复杂。IO-IO联合和联合化疗中价值也不一样,取决于联合治疗方案的原理,有些联合用药方案只对TMB-H或TMB-L中的一组有效,那么TMB就有价值,建议关注Keynote- 495/KeyImPaCT研究。
TMB检测呼唤标准
TMB是一个研究中的指标,尚无相应的行业标准和共识出台,panel设计、算法、评判TMB高低的cut-off值都缺乏标准,不同临床试验采取不同检测机构提供的TMB检测结果不具有可比性,临床应用必须基于临床性能验证和前瞻性研究结果数据。
Keynote 189和021研究中使用的都是WES数据计算TMB,使用WES测序深度不及大panel,以及一些特定区域也需要优化,都会影响最终的TMB计算。在阈值设定方面,Keynote 189研究设定175 mut/exome为TMB-H的cut-off值,TMB-H的患者占到了45.7%,可能会稀释TMB的预测效能。
tTMB可能会有肿瘤组织异质性带来的影响,对于穿刺等小标本来说异质性的问题更为突出。未来血液版TMB(bTMB)可能效果会更好,因为克服了异质性。
粗放的突变计数并不能直接反映肿瘤的免疫原性,还需要考虑克隆性、表达情况、抗原呈递功能的完整性等。例如通过检测肿瘤组织中HLA LOH(杂合性缺失)是否发生,来辅助提升TMB的疗效预测的准确性。
TMB或免疫诊断未来的发展方向
大panel检测的意义不只在于计算TMB,在于使用一次获得的有限样本做尽可能全面的检测,为临床治疗方案的选择、序贯提供全面参考,TMB只是其中一个指标,不是全部。免疫效应标志物的应用中,单一的标志物不会提供“完美”的解决方案,生物标志物的组合更有可能提供更好的疗效预测敏感性。
基于肿瘤免疫的多因子特性,单一运用任何一个biomarker可能都是不够充分的,需要综合评估分析肿瘤与宿主免疫系统的相互作用,从而建立预测模型,太阳集团tyc官方入口正在进行这样的探索。
未来的免疫诊断方向,可能不仅关注优势人群筛选,还会关注耐药或者不良反应事件的预测,即通过biomarkers把无效和“有毒”人群筛选出来,预测这一类无疗效或者禁忌的患者。以往认为免疫治疗中需要排除驱动基因阳性的患者,如NSCLC患者中EGFR、ALK、ROS1、MET阳性者,但一些研究也有不同的声音,还需要更多数据的积累。
免疫疗效最终取决于新生抗原的质量而非数量,患者是否具有高质量新生抗原是根本。基于可靠的算法直接评估患者的高质量新生抗原,应用基于经过验证的新生抗原个体化治疗,将助力未来免疫治疗疗效的进一步提升。
小 结
“千淘万漉虽辛苦,吹尽狂沙始到金”!
TMB作为一个尚在研究之中的生物标志物,最终还是要回归其本质——反映肿瘤本身的免疫原性。我们对待TMB的态度,盲目追捧或是跟风都是不合适的,如何开发出最能反映TMB本质的检测方法,应当是检测公司的本分。
实现肿瘤精准免疫诊疗亦道阻且长,需要建立综合多个biomarker综合评估模型,需要更多前瞻性的临床研究数据的积累和验证,需要时刻关注临床需求,基于肿瘤免疫的基础原理开发产品,必定能一点一点地接近我们的使命——让肿瘤免疫更有效,让更多的肿瘤患者从免疫治疗中获益。
参考文献
1.Matthew D. Hellmann, M.D., et al. Nivolumab plus Ipilimumab in Lung Cancer with a High Tumor Mutational Burden. N Engl J Med 2018; 378:2093-2104.
2.Bristol-Myers Squibb Provides Update on the Ongoing Regulatory Review of Opdivo Plus Low-Dose Yervoy in First-Line Lung CancerPatients with Tumor Mutational Burden ≥10 mut/Mb.
3.https://www.prnewswire.co.uk/news-releases/iaslc-world-conference-on-lung-cancer-press-briefing-summary-from-sunday-september-8th-817917897.html.
4.https://www.iaslc.org/About-IASLC/News-Detail/keynote-189-tumor-mutational-burden-not-significantly-associated-with-efficacy-of-pembrolizumab.
5.https://www.iaslc.org/About-IASLC/News-Detail/new-keynote-021-data-shows-no-association-with-tumor-mutational-burden.
6. D.P. Carbone, et al. First-Line Nivolumab in Stage IV or Recurrent Non-Small-Cell Lung Cancer. N Engl J Med. N Engl J Med. 2017 Jun 22; 376(25): 2415–2426.
【 返回列表 】
Copyright©2021
太阳集团tyc官方入口 - 太阳集团游戏官方网址 版权所有
粤ICP备16128839号
